El protocolo de estudio de la Fase 2/3 sigue todas las directrices de la Administración de Alimentos y Medicamentos de los Estados Unidos.
Por Revista Summa
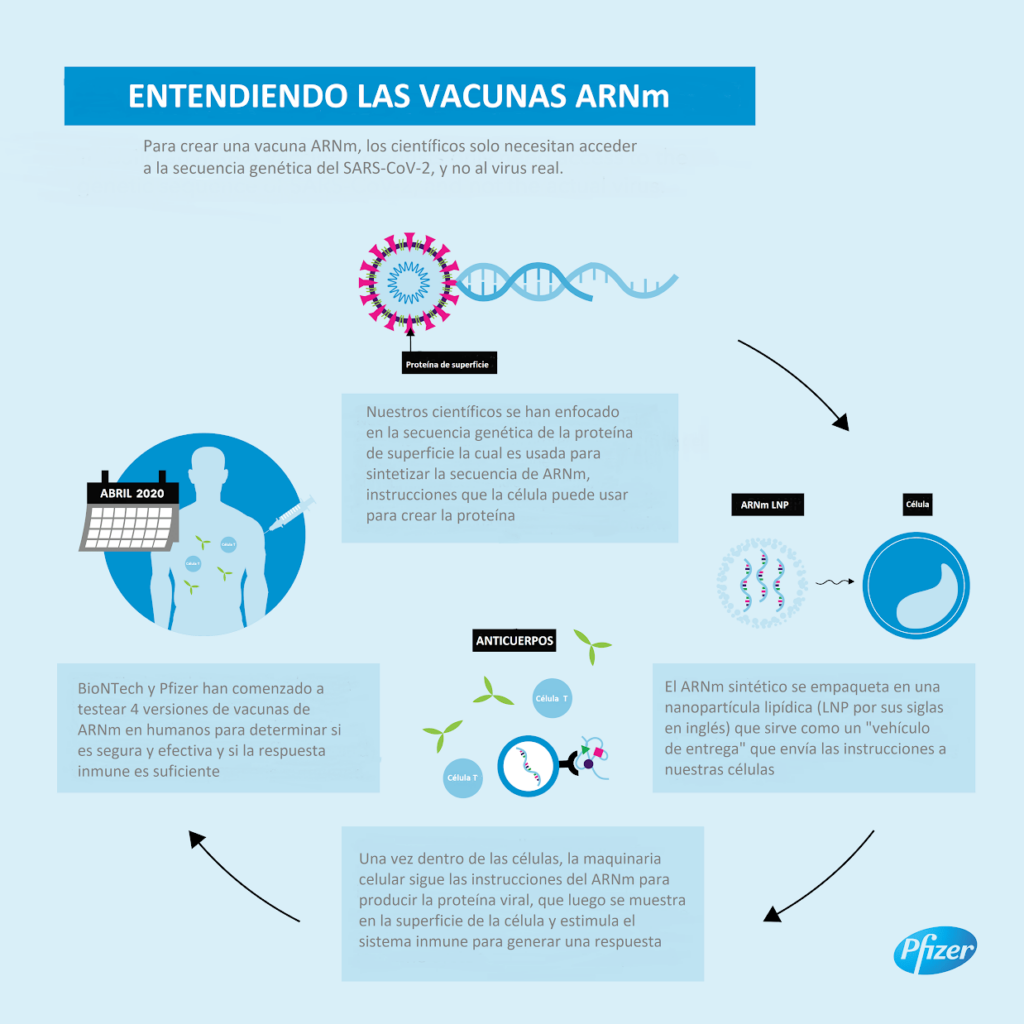
Pfizer Inc. y BioNTech SE anunciaron el inicio de un estudio clínico global (excepto en China) Fase 2/3 de seguridad y eficacia para evaluar a un candidato de ARN mensajero modificado con un único nucleósido (modARN) de su programa de vacunas basado en BNT162 ARNm contra SARS-CoV-2.
Después de una extensa revisión de los datos preclínicos y clínicos de los ensayos de Fase 1/2, y en colaboración con el Centro de Evaluación e Investigación Biológica (CBER) de la FDA, entre otros reguladores mundiales, Pfizer y BioNTech han optado por avanzar su candidato a la vacuna BNT162b2 en el estudio Fase 2/3, a un nivel de dosis de 30 μg en un régimen de 2 dosis. Dicho candidato de vacuna, que recientemente recibió la designación “Fast Track” de la FDA, codifica una glicoproteína de longitud completa (Proteína S) de SARS-CoV-2, convirtiéndola en el objetivo de los anticuerpos neutralizantes del virus.
“Nuestra selección del candidato a la vacuna BNT162b2 y su avance a un estudio de Fase 2/3 son la culminación de un programa de I+D amplio, colaborativo y sin precedentes en el que participaron Pfizer, BioNTech, investigadores clínicos y participantes del estudio, con el enfoque singular de desarrollar una vacuna ARN contra el COVID-19 segura y eficaz. El protocolo de estudio Fase 2/3 sigue todas las directrices de la Administración de Alimentos y Medicamentos de los Estados Unidos, respecto al diseño de ensayos clínicos para estudios de vacunas COVID-19”, dijo Kathrin U. Jansen, Ph.D., Vicepresidenta Senior y Jefa de
Investigación y Desarrollo de Vacunas en Pfizer. “El inicio del ensayo de Fase 2/3 es un gran paso para nuestro progreso hacia el suministro de una vacuna potencial que ayude a combatir la pandemia COVID-19 en curso y esperamos generar datos adicionales a medida que el programa avance”.
“Hoy, estamos comenzando nuestro estudio global en etapas tardías de la enfermedad, que incluirá hasta 30.000 participantes. Seleccionamos la BNT162b2 como nuestra candidata principal para esta prueba de Fase 2/3 tras una diligente evaluación de la totalidad de los datos generados hasta el momento. Esta decisión refleja nuestro objetivo principal de llevar una vacuna bien tolerada y altamente eficaz al mercado lo más rápido posible, mientras continuamos evaluando a nuestras otras vacunas candidatas como parte de una cartera diferenciada de vacunas para COVID-19”, aseguró Ugur Sahin, CEO y cofundador de BioNTech.
“Se han dado muchos pasos hacia este importante hito y nos gustaría dar las gracias a todos los involucrados por su extraordinario compromiso”.
Durante los estudios preclínicos y clínicos de cuatro candidatas a la vacuna de ARN BNT162, las opciones BNT162b1 y BNT162b2 surgieron como candidatas fuertes basado en evaluaciones de seguridad y respuesta inmunitaria. Pfizer y BioNTech seleccionaron BNT162b2 como la vacuna candidata para avanzar a un estudio de Fase 2/3 basado en la totalidad de los datos disponibles de nuestros estudios preclínicos y clínicos, incluyendo parámetros selectos de respuesta inmune y tolerabilidad.
En los estudios preclínicos, las candidatas BNT162b1 y BNT162b2 indujeron respuestas de células CD4+ y CD8+T específicas de antígenos virales favorables, altos niveles de anticuerpos neutralizantes en diversas especies animales y efectos protectores benéficos en un modelo de desafío SARS-CoV-2 en primates.
Pfizer y BioNTech finalizaron el protocolo de estudio Fase 2/3 en respuesta a los comentarios de los reguladores globales, incluyendo la FDA y el alemán Paul-Ehrlich-Institut. El estudio de Fase 2/3 es un ensayo “impulsado por suceso” que está previsto que inscriba hasta 30.000 participantes entre 18 y 85 años de edad. Las empresas planean inscribir a una población diversa, incluyendo participantes en áreas donde hay una esperada transmisión significativa de SARS-CoV-2.
El ensayo de Fase 2/3 está diseñado como 1:1 vacuna candidata contra placebo, en un estudio aleatorio, ciego por observador para obtener los datos de seguridad, respuesta inmune y eficacia necesarios para la revisión regulatoria. Los puntos finales primarios del ensayo serán la prevención del COVID-19 en aquellos que no han sido infectados por SARS-CoV-2 antes de la inmunización y la prevención del COVID-19 independientemente de que los participantes hayan sido infectados previamente por SARS-CoV-2. Los puntos finales secundarios incluyen la prevención del COVID-19 grave en dichos grupos. El estudio también explorará la prevención de la infección por SARS-CoV-2, el virus que causa el COVID-19. El análisis de eficacia primaria será un análisis “impulsado por suceso” basado en el número de participantes con enfermedad sintomática del COVID-19. El diseño del ensayo permite análisis provisionales y revisiones no cegadas por un Comité de Monitoreo de Datos externo independiente.
Para el final del ensayo, se espera que el estudio Fase 2/3 se realice en aproximadamente 120 sitios de investigación clínica alrededor del mundo, incluidos 39 estados de Estados Unidos y países como Argentina, Brasil y Alemania. Los sitios de investigadores se seleccionan en función de factores como la experiencia y las capacidades científicas, la epidemiología de la enfermedad y la experiencia previa en la realización de ensayos clínicos.